thầy cho em hỏi cách tính pH của dung dịch đệm ạ
tính pH của dung dịch đệm gồm CH3COOH 0.1M và CH3COONa 0.1M biết hằng số điện li của CH3COOH là 1,76.10^-5
Dung dịch có chứa CH3COOH 0,1M và CH3COONa 0,1M. Tính độ pH của dung dịch. Biết rằng hằng số axit của CH3COOH là Ka = 10-4,76.
Sửa đề bài Vì CH3COONa là chất điện li mạnh nên được viết trước để tạo môi trường cho cân bằng của chất điện li yếu phân li và cân bằng:
CH³COOH ⇔ CH³COO -+H+
Ban đầu 0,1 0. 0
Phân li xM x. x
Cân bằng 0,1-x 0,1+x x
Suy ra K = \(\dfrac{x(x+0,1)}{0,1-x}\) = 1,8.10 mũ âm ⁵
⇒ x = 1,8 . 10 mũ âm ⁵
⇒pH = log x = 1745
Cho hằng số điện ly của NH4+ là 5.10-5 . Tính pH của dung dịch gồm NH4Cl 0.2M và NH3 0.1M
Dung dịch X gồm CH3COOH 0,03M và CH3COONa 0,01M. Biết ở 250C; Ka của CH3COOH là 1,75.10-5; bỏ qua sự phân li của nước. Giá trị pH của dung dịch X ở 250C là:
A. 4,28
B. 4,04
C. 4,76
D. 6,28
Do đây là dung dịch đệm nên ta có CT tính nhanh : pH = pKa + log(Cb/Ca) (Ca là nồng độ mol của axit ; Cb là nồng độ mol của muối)
=> pH = 4,28
=>A
Cho dung dịch X chứa hỗn hợp gồm CH3COOH 0,1 M và CH3COONa 0,1 M. Biết ở 25°C, K của CH3COOH là 1,75.10-5 và bỏ qua sự phân li của nước. Giá trị pH của dung dịch X ở 25°C là:
A. 1,00
B. 4,24
C. 2,88
D. 4,76
Vì muối CH3COONa là chất điện li mạnh nên ta có
![]()
Do đó sau quá trình trên trong dung dịch có nồng độ của ion CH3COO- là 0,1.
Xét cân bằng điện li: CH3COOH + H2O ⇌ CH3COO- + H3O+
Nồng độ ban đầu: 0,1 0,1 0
Nồng độ phân li: x(M) → x x
Nồng độ cân bằng: 0,1 – x 0,1 + x x
Thay các giá trị ở trạng thái cân bằng vào công thức tính hằng số điện li thì ta có
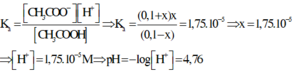
Đáp án D.
Cho 0.03 mol axit HCl vào 1 L của dung dịch đệm
có nồng độ 0,6 M CH3COOH and 0,6M
CH3COONa. Tính pH của dung dịch. Biết hằng số
phân li của axit CH3COOH là: 1,8x10-5 ở 25oC
$CH_3COONa + HCl \to CH_3COOH + NaCl$
$n_{CH_3COOH} = 0,6.1 + 0,03 = 0,63(mol)$
$[H^+] = 0,63.1,8.10^{-5} = 1,134.10^{-5}M$
$pH = -log([H^+]) = -log(1,134.10^{-5}) = 4,945$
Cho 2 dung dịch HCl và CH3COOH có cùng nồng độ. Dung dịch HCl có pH = x, dung dịch CH3COOH có pH = y. Bỏ qua sự điện li của nước, các dung dịch ở cùng nhiệt độ phòng. Biết ở nhiệt độ phòng, cứ 100 phân tử CH3COOH thì có 1 phân tử phân li ra ion. Mối liên hệ của x và y là:
A. x = y - 2
B. y = x – 2
C. x = 2y
D. y = 2x
Không mất tính tổng quát, ta đặt:
![]()
Vì HCl là chất điện li mạnh nên ta có phương trình điện li như sau:
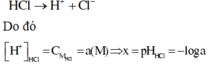
Vì CH3COOH là chất điện li yếu nên ta có phương trình điện li như sau
Xét cân bằng điện li: CH3COOH ⇌ CH3COO- + H+
Nồng độ ban đầu: aM 0
Nồng độ phân li: 0,01a M → 0,01a M
Nồng độ cân bằng: 0,99a M 0,01a M
Ta có
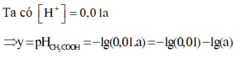
![]()
Đáp án A.
Hỗn hợp dung dịch X gồm NaOH 0.1M và KOH 0.1M. Trộn 100 ml dung dịch X với 100 ml dung dịch
H2SO4 0.2M thu được dung dịch A.
a. Tính nồng độ các ion trong dung dịch A.
b. Tính pH của dung dịch A.
Hỗn hợp dung dịch X gồm NaOH 0.1M và KOH 0.1M. Trộn 100 ml dung dịch X với 100 ml dung dịch
H2SO4 0.2M thu được dung dịch A.
a. Tính nồng độ các ion trong dung dịch A.
b. Tính pH của dung dịch A.
a, \(\left[Na^+\right]=0,1\)
\(\left[K^+\right]=0,1\)
\(\left[OH^-\right]=0,2\)
\(\left[SO_4^{2-}\right]=0,2\)
\(\left[H^+\right]=0,4\)
b, \(n_{H^+}=0,1.0,4=0,04\left(mol\right)\)
\(n_{OH^-}=0,1.0,2=0,02\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
\(\Rightarrow n_{H^+dư}=0,02\left(mol\right)\)
\(\Rightarrow\left[H^+\right]=\dfrac{0,02}{200}=10^{-4}\)
\(\Rightarrow pH=4\)
Hỗn hợp dung dịch X gồm NaOH 0.1M và KOH 0.1M. Trộn 100 ml dung dịch X với 100 ml dung dịch
H2SO4 0.2M thu được dung dịch A.
a. Tính nồng độ các ion trong dung dịch A.
b. Tính pH của dung dịch A.
$n_{NaOH} = n_{KOH} = 0,1.0,1 = 0,01(mol)$
$n_{H_2SO_4} = 0,02(mol)$
OH- + H+ → H2O
Bđ : 0,01...0,04..................(mol)
Pư : 0,01...0,01...................(mol)
Sau pư : 0......0,03...................(mol)
$V_{dd} = 0,1 + 0,1 = 0,2(lít)$
Vậy :
$[K^+] = [Na^+] = \dfrac{0,01}{0,2} = 0,05M$
$[H^+] = \dfrac{0,03}{0,2} = 0,15M$
$[SO_4^{2-}] = \dfrac{0,02}{0,2} = 0,1M$
b)
$pH = -log(0,15) = 0,824$